Investigadores del Johns Hopkins All Children’s Hospital revelan una novedosa estrategia para potenciar la respuesta inmunitaria contra tumores "fríos" mediante la formación de estructuras similares a "cráteres" o nichos dentro de los tumores, donde las células T y B coordinan un ataque efectivo, mejorando la supervivencia y reduciendo recurrencias en modelos preclínicos.
El equipo de científicos liderado por el Dr. Masanobu Komatsu ha publicado recientemente en Nature Immunology un estudio que muestra cómo transformar tumores de difícil tratamiento, conocidos como inmunológicamente "fríos", en focos activos donde la respuesta inmune se amplifica gracias a la formación de estructuras especializadas llamadas estructuras linfoides terciarias (TLS, por sus siglas en inglés).
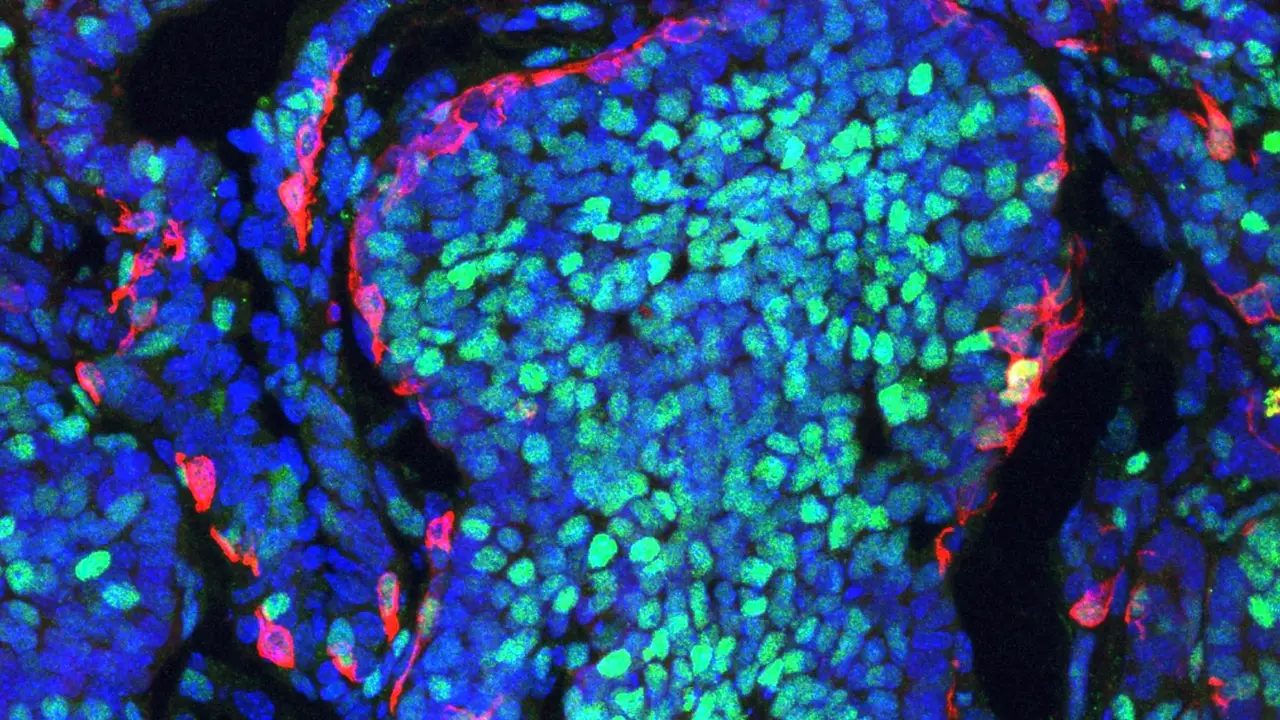
Los TLS son grupos organizados de células inmunitarias, principalmente linfocitos T y B, que actúan como nodos de coordinación para el ataque contra las células tumorales. Estas estructuras se asemejan a "cráteres" o nichos dentro del microambiente tumoral, facilitando una infiltración eficiente y sostenida de células inmunes que mejoran la capacidad de destrucción de las células cancerosas.
Mediante la activación conjunta de dos proteínas —las vías STING y el receptor LTβR— los investigadores lograron inducir la formación de TLS dentro de tumores en modelos murinos de cáncer de mama, páncreas y músculo. Esta activación generó un aumento notable en la migración de células T citotóxicas CD8⁺ y células B, así como la formación de nuevos vasos sanguíneos especializados para la entrada de células inmunitarias.
El estudio también demostró que dentro de estas TLS, las células B iniciaban reacciones de centro germinal, convirtiéndose en células plasmáticas productoras de anticuerpos altamente específicas contra el tumor y estableciendo memoria inmunológica duradera. Este fenómeno condujo a una supresión sostenida del crecimiento tumoral y previno la recurrencia del cáncer en los modelos estudiados.
Además, el balance entre inmunidad mediada por anticuerpos y por células T se vio reforzado, potenciando tanto la eliminación directa de células malignas como la generación de una respuesta inmune adaptativa robusta y a largo plazo.
El Dr. Komatsu señaló que esta terapia para inducir TLS representa una vía prometedora para mejorar la eficacia de tratamientos convencionales como la quimioterapia y la inmunoterapia con inhibidores de puntos de control, especialmente en pacientes cuyos tumores no responden inicialmente debido a un microambiente inmunosupresor.
Este hallazgo es crucial porque muchos tipos de tumores "fríos" son menos visibles para el sistema inmune y presentan una peor prognosis. Al crear un entorno inmunológicamente "caliente", la posibilidad de controlar el cáncer aumenta significativamente.
El equipo continúa investigando los mecanismos moleculares exactos y prepara ensayos clínicos para evaluar la aplicación de agentes estimuladores de STING y LTβR en pacientes humanos, con la esperanza de ofrecer nuevas opciones terapéuticas personalizadas para mejorar la supervivencia y calidad de vida en cáncer.
Esta investigación, apoyada por el Instituto Nacional del Cáncer de EE. UU. y otros fondos, representa un avance en la oncología inmunológica y la medicina personalizada, y abre puertas para futuras terapias basadas en la modulación del sistema inmunitario dentro del tumor.